The source-page: http://www.tulane.edu/~wiser/protozoology/notes/malaria.html
| Tarihsel Özeti | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Sıtma olmuş ve hala çok insan morbidite ve mortalite nedenidir. Hastalık en çok ılıman bölgelerde yok edildiğine rağmen, tropik ve tropik altı büyük bölümünde endemik olmaya devam ediyor.Dünya nüfusunun yüzde kırkı endemik bölgelerde yaşar. Salgın hastalıklar, büyük popülasyonları harap ve sıtma gelişmekte olan birçok ülkede ekonomik ilerleme için ciddi engel teşkil etmektedir. 1,5-2700000 ölümle yılda klinik hastalığın tahminen 300-500.000.000 durumlar vardır. Çin, Asur ve Hindistan’dan bilinen en eski tıbbi yazıları bazıları doğru sıtma benzeri aralıklı ateş açıklar. Parazit önce Hipokrat, ‘tıbbın babası’, genel olarak, 500 M.Ö. klinik belirtilerin ilk bilgi ile 2000’den fazla yıl yansıtılır tarif edildiği gibi (Tablo). [Ayrıca Wikipedia makalesine bakın Sıtma Tarihi]
- Yaşam döngüsü
- Klinik bulgular
- Patogenez ve Serebral Sıtma
- Epidemiyoloji ve Kontrol
- Teşhis
- Kemoterapi ve ilaç direnci
Sıtma cinsinin üyeleri kaynaklanır Plasmodium. Plasmodium türleri Apicomplexa (bakınız Apicomplexa genel açıklama) ve, bir omurgalı konakçının ve eklembacaklı vektörü içeren bir heteroxenous ömrü sergiler. Omurgalı barındıran şunlardır: sürüngenler, kuşlar, kemirgenler, maymunlar ve insanlar. Plasmodium türleri, genel olarak her türün sadece ana ve vektörler, sınırlı olarak enfekte olacak belirli ve vektör spesifik ana edilir. Dört ayrı türler enfekte insanlar: P. falciparum, P. vivax, P. ovale ve P. malariae. (Türler farklara sayfasına bakın) Türleri yaşam döngüleri ve klinik belirtilerinin bilgilerini morfolojilerine açısından farklılık gösterir.
Yaşam döngüsü
İnsan ve diğer memelilerin Plasmodium türleri anopheline türü sivrisinekler tarafından iletilir. Parazit sivrisinek besleme sırasında tükürük ile enjekte edilmiş ve ilk eritrositlerde merogony birden fazla tur ve ardından karaciğerde merogony yuvarlak maruz kalır. Gametogony omurgalı konağın eritrositler içinde başlar ve sporogony gerçekleşir sivrisinek içinde tamamlanır. Bu yaşam döngüsü aseksüel replikasyon ve tipik apikal organlı invaziv aşamaları oluşumu ile karakterize edilen diğer Apikompleksan parazitlerin genel özelliklerini gösterir.
Karaciğer Sahne. Zaman insan enfeksiyonu başlatılır sporozoitler sivrisinek besleme sırasında tükürük ile enjekte edilir. Sporozoitler dolaşım sistemini girip 30-60 dakika içinde bir karaciğer hücresi istila edecek. Tüm Apicomplexa olduğu gibi hücre girişini Ev Sahipliği, apikal organellerin tarafından kolaylaştırılır. Hepatosit işgal ettikten sonra, parazit bir aseksüel çoğaltma uğrar. Bu, kopyalama aşaması genellikle denir exoerythrocytic (veya ön-eritrosit) schizogony. Schizogony parazit soyunu oluşturmak için, sitoplazmik bir tomurcuklanma, ardından bölüm, veya segmentasyon olmaksızın nükleer bölünme birden fazla tur girdiği bir replikatif işlemi belirtir. Soyu denilen merozoitler, ev sahibi hepatosit yırtılmasına aşağıdaki dolaşım sistemi içine bırakılır. (Yaşam döngüsü şekle bakın)
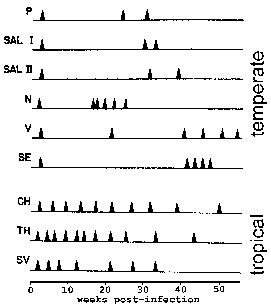
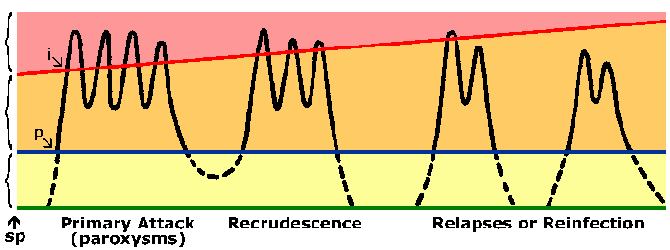
In P. vivax ve P. ovale sporozoitlenn bazı aseksüel çoğaltma tabi hemen değil, ama bilinen bir atıl safhasına girmek hypnozoite. (Bununla birlikte, olmadığı hakkında bazı sorular P. ovale sergiler hypnozoite aşamasında gündeme gelmiş Richter ve ark, Parazitoloji Araştırma 107 2010 Bkz:.. 1285) Bu hypnozoite yeniden ve bir relaps sonuçlanan daha sonraki bir zamanda schizogony altına alınabilir. Nüks sıtma açısından özel bir anlama sahiptir ve hypnozoites ile enfeksiyonun yeniden aktive edilmesine değinmektedir. Yeniden kötüleşme Parazitemi fark edilebilecek seviyenin altına düşer ve daha sonra, bir patent parazitemi için artar durumu tarif etmek için kullanılır. İlginç bir şekilde, ılıman bölgelerinde izole edilen primer enfeksiyon ve sürekli iletim (Şekil) tropikal bölgelerde suşlara göre relaps arasında uzun bir latent dönem sergileme eğilimindedirler.
Kan Sahne. Merozoitler enfekte karaciğer hücrelerinden salınan eritrositler istila. Merozoitler eritrosit yüzeyine belirli proteinleri tanıyan ve aktif diğer Apikompleksan parazitler benzer bir şekilde hücre işgal eder. (Ilgili bilgileri konakçı hücre istilası mekanizması). Parazit aseksüel çoğaltma ardından trofik bir süre maruz eritrosit girdikten sonra. Genç trophozoite genellikle adlandırılır halka formu nedeniyle Geimsa lekeli kan lekeleriyle kendi morfolojisine. Boyutunda parazit arttıkça bu ‘halka’ morfolojisi kaybolur ve bir denir trofozoit. Trofik dönemde parazit konakçı hücre sitoplazmasına yutar amino asitlere hemoglobin yıkar. Hemoglobin sindirim bir yan ürün sıtma pigment ya da hemozoin olup. (Notlarına bakınız gıda vakuol arasında Plasmodium.), Siyah granüllere Bu altın kahverengi kan aşamalı bir parazit ayırt edici özelliği olarak kabul edilmiştir.
Nükleer bölünme trofozoit aşamasının sonu ve başlangıcıdır şizont aşamasında. Eritrosit schizogongy bir tomurcuklanma sürecinin ardından nükleer replikasyon 3-5 mermi (türüne bağlı olarak) oluşur. Bireysel merozoitler ayırt edilebilir hale geldiği Geç evre şizontlarm denir segmenters. Konak eritrosit kırılmaları ve bültenleri merozoitler. Bu merozoitler yeni eritrositler istila ve schizogony bir turunu başlatmak. Bir konak içinde kan aşamalı parazitleri genellikle senkron schizogony uğrarlar. Enfekte eritrositler ve antijenleri ve atık ürünlerin birbirlerinden ayrılması eş zamanlı kopma aralıklı hesapları ateş paroksizimli sıtma ile ilişkili. Kan sahne schizogony içinde Plasmodium falciparum bu trophozoite- ve şizont-enfeksiyonlu eritrosit diğer insan sıtma parazitlerinin farklıdır endotel hücrelerinin kapiler bağlı ve periferik dolaşım bulunmayan. Bu ayırma ile ilişkilidir serebral sıtma. (Yaşam döngüsü şekle bakın.)
Cinsel Sahne. Bir alternatif olarak bir cinsel döngüsünü geçirecek parazitlerin bazı schizogony ve ölümcül ya içine ayırt mikro veya macrogametocytes. Gametocytogenesis uyarımına katılan faktörler bilinen değildir. Ancak, cinsel aşamaya taahhüt hemen gametosit oluşumları önündeki eşeysiz eritrosit döngüsü sırasında gerçekleşir. Bu şizont gelen kızı merozoitler tüm aseksüel formlar veya tüm cinsel formları ya dönüşecek. Gametositlere insan konakta patoloji neden olmaz ve bir sivrisinek tarafından alınmadığı takdirde dolaşıma kaybolur.
Gametogenez veya oluşumu, mikro ve macrogametes gametositler bir sivrisinek tarafından sindirilen zaman indüklenir. Sivrisinek tarafından yutulması sonrasında microgametocyte nükleer replikasyon üç mermi uğrar. Bunlar sekiz çekirdek daha sonra microgametocyte gövdesinden çıkan flagella ile ilişkili hale gelir. Bu süreç nedeniyle dayak flagella için ışık mikroskobu ile kolayca gözlemlenebilir ve exflagellation denir. Macrogametocytes macrogametes olgunlaşır. Ancak, morfolojik düzeyde bu kadar az dramatik microgametocytes tarafından sergilenen exflagellation aşıyor.
| Gametogenez / Exflagellation |
|---|
|
Exflagellation enfekte kan havaya maruz kendiliğinden oluşur.Bu gametogenez uyarımına katılan kritik faktörler sıcaklığında bir düşme, çözünmüş karbon dioksit bir azalma ve 8.0 (Box) üzerinde pH müteakip artıştır. Bu biraz kan pH 7.4 ile karşılaştırıldığında, yaklaşık 7.8 arasında bir pH değerine sahip olması ile gametositler yaşadığı çevresel değişiklikler, ortam sıcaklığında bir değişiklik ve sivrisinek bağırsak olacak taklit eder. Buna ek olarak, bir sivrisinek kaynaklı exflagellation faktörü (MEF) de tarif edilmiş ve ksantürenik asit, böceklerden bir metabolit olarak tanımlanır. Ksantürenik asit 8.0 altına exflagellation izin veren pH’ı düşürür ve muhtemelen parazit Gametogenezis geçmesi için biyolojik işaret olduğu (Billker ve arkadaşları, Nature 392: 289, 1998; Billker ve arkadaşları, Celi 117: 503, 2004).
Son derece mobil microgametes ararlar ve bir macrogamete ile kaynaştırmak olacaktır. 12-24 saat içinde ortaya çıkan zigotun bir içine geliştirir ookinete. Ookinete peritrofik matris ve sivrisinek orta-mide epitelyum hem de enine bir hareketli invaziv aşamasıdır. Orta bağırsak epiteli Rikter istila ve epiteli bazal tarafında yükselen önce birkaç epitel hücreleri çıkarken içerir. Ookinete rhoptries yok ve konak hücrenin istila sonra parasitophorous çarpıtma oluşturmadığı dışında işgali süreci diğer Apicomplexa benzer. (Ilgili ayrıntılara bakın konak hücre istilasının mekanizması.)
Sporogony. Epitel hücreleri ve bazal lamina arasındaki hücre dışı alanı ulaştıktan sonra, ookinete bir içine geliştirir Ookist. Oositleri birkaç bin üretimi ile sonuçlanacak sporogony adı verilen bir eşeysiz çoğaltma, maruz sporozoitler. Bu genellikle, türler ve sıcaklığına bağlı olarak 10-28 gün sürer.Olgunlaşması sırasında Ookist kırılır ve serbest bırakır sivrisinek hemokoyeline (beden kavitesi,) içine bazal lamina çapraz sporozoitler. (Yaşam döngüsü şekle bakın.)
Bu sporozoitler hareketli ve özellikle tükürük bezlerini tanımak için bir yeteneği var. Tükürük bulduktan sonra sporozoitler istila edip tükürük bezi epitel hücreleri enine ve lümen içinde yalan gelecek bezleri. Sivrisinek kan ile beslendiğinde ve böylece olarak bu sporozoitlerine bazıları omurgalı konak içine ihraç edilecek omurgalı konakta enfeksiyonu yeniden başlatmak. Hemokoyeline ve tükürük bezi sporozoitler morfolojik olarak benzer olmasına rağmen, bunlar işlevsel olarak ayrıdır. Tükürük bezi sporozoitler verimli karaciğer hücrelerini istila ama hemokoyeline sporozoitler karaciğer hücreleri istila de verimsiz olduğu, oysa tükürük bezleri yeniden işgal edemeyiz.
Özetle, sıtma paraziti olan bir yaşam döngüsü sergileyen tipik Apikompleksan özellikleri. Sporozoit, merozoit ve ookinete: üç farklı invaziv aşama vardır. Tüm apikal organeller tarafından karakterize edilmiştir ve istila veya konakçı hücreler geçebilir. Merogony iki ayrı tipi görülmektedir. İlk olarak adlandırılan exoerythrocytic schizogony, karaciğerde meydana gelir ve sporozoit ile başlatılır. Ortaya çıkan merozoitler sonra eritrositler istila edip eritrosit schizogony denilen merogony tekrarlanan mermi uğrarlar. Eritrosit schizogony üretilen merozoitlerin Bazı gamogony geçirecek. Plasmodium gamogony iki aşamada açıklanmıştır: gametocytogenesis omurgalı konağın kan dolaşımında oluşan ve Gametogenezis sivrisinek bağırsaklarında meydana gelen. gametler ilk olarak ookinete içine geliştirir bir zigot haline kaynaştırmak ve sonra sporogony gerçekleşir bir oosit haline gelir.
(Sivrisinek içinde yaşam döngüsünün inceleme için LA Baton 2005 LC Ranford-Cartwright () tohumlarını Yayılma milyon katili ölüm bkz. Sıtma metamorfozuna sivrisinek Parazitoloji 21 573-580 Eğilimler.
Klinik bulgular
Sıtma ile bağlantılı patoloji ve klinik bulgular nedeniyle eşeysiz eritrosit aşama parazitlere neredeyse sadece. Doku şizontlarm ve gametositler, varsa patolojiye biraz neden olur. Plasmodium enfeksiyonu 48 veya 72 ya saatlik aralıklarla oluşan onun periyodik ateş paroksizmli için en önemli olan akut ateşli hastalığa neden olur. Saldırının şiddetine bağlıdır, Plasmodium bu durumu gibi türler aynı zamanda, diğer durumlarda bağışıklık ve genel sağlık ve enfekte bireyin beslenme durumu.Sıtma bir relaps eğilimi veya açılmak (bakınız olan kronik bir hastalıktır farkın açıklama aylar hatta yıllar boyunca).
Sıtma elde etmek için en yaygın yolu sivrisinekler (bkz doğal iletim yoluyla yaşam döngüsü). Sıtma ayrıca kan nakli veya paylaşım şırınga yoluyla bulaşabilir. Bir karaciğer aşaması olacaktır çünkü enfekte kan mekanik transmisyon daha kısa bir kuluçka dönemi ile sonuçlanacaktır. Mekanik yolla bulaşan ile ölüm riski de vardır P. falciparum. Karaciğer aşamasında enfeksiyon eksikliği de engeller relaps olarak, P. vivax veya P. ovale enfeksiyonlar. Konjenital iletim de belgelenmiştir, ancak plasenta ağır enfeksiyon rağmen oldukça nadir olduğuna inanılmaktadır.
| Exoerythrocytic schizogony ve prepatent ve kuluçka dönemleri | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Sıtma belirtileri genellikle 10-15 gün virüslü sivrisineğin ısırması sonrası görünmeye başlar. Sporozoit aşılama Aşağıda, tipik prepatent ve inkübasyon süresi türleri (Tablo) göre değişir. Prepatent süresi sporozoit aşılama ve kanındaki parazitlerin görünüşü arasında süre olarak tanımlanır ve karaciğer aşamasının süresi ve üretilen merozoit sayısını temsil eder. İnkübasyon süreleri biraz daha uzun olma eğilimindedir ve sporozoit aşılama ve semptomların başlangıcı arasındaki süre olarak tanımlanır. Bazen inkübasyon süreleri birkaç ay uzatılabilir, P. vivax, P. ovale, ve P. malarya. Dört tür ilk ateşli saldırıdan birkaç gün önce spesifik olmayan prodromal semptomları sergileyebilir. Bu prodromal semptomlar genellikle ‘grip benzeri’ olarak tanımlanan ve aşağıdakileri içerir: baş ağrısı, hafif ateş, kas ağrısı, iştahsızlık, bulantı ve halsizlik.Semptomlar parazitlerin sayısındaki artış ile ilişkili eğilimindedir.
Bu prodromal semptomlar da sıtma paroksizme olarak bilinen ateşli saldırılar takip edecek. Bu paroksizmleri 48 saat için dönemlilik sergiler, P. vivax, P. ovale ve P. falciparum ve bir 72 saat periyodik S. malarya. Farklı exoerythrocytic schizontsun gelen merozoitlerin damızlıkların senkronize olarak Başlangıçta bu paroxyms görülme süreleri düzensiz olabilir. Bu özellikle doğrudur P. falciparum farklı paroksismal sergiler, ancak sürekli bir ateş, günlük ataklar ya da düzensiz atak (örneğin., 36-48 saatlik periyodiklik) göstermeyebilirler. Hastalar aynı zamanda sıtma paroksizmleri meydana dönem boyunca, splenomegali hepatomegali (hafif sarılık) ve hemolitik anemi sergileyebilir.
Sıtma atağı (Tablo) olacak genellikle son 4-8 saat ve hasta yüksek bir sıcaklığa sahip olmasına rağmen, soğuk bir yoğun bir şekilde maruz kaldığı soğuk alma ani başlangıçlı ile başlar. Bu genellikle soğuk aşama olarak adlandırılır ve güçlü bir titreme ile karakterize edilir. Hemen bu soğuk aşamayı şu sıcak aşamadır.Hasta şiddetli baş ağrısı eşlik yoğun ısıyı hisseder. Yorgunluk, baş dönmesi, anoreksi, miyalji ve mide bulantısı, genellikle sıcak aşama ile ilişkili olacaktır. Sonraki bol terleme bir dönem meydana gelir ve ateş düşmeye başlayacaktır. Hasta bitkin ve zayıf ve genellikle uykuya dalacak. Uyanış üzerine hasta genellikle yorgun olmaktan çok, diğer hisseder ve bir sonraki haddine başlamasına kadar belirtilerini göstermez.
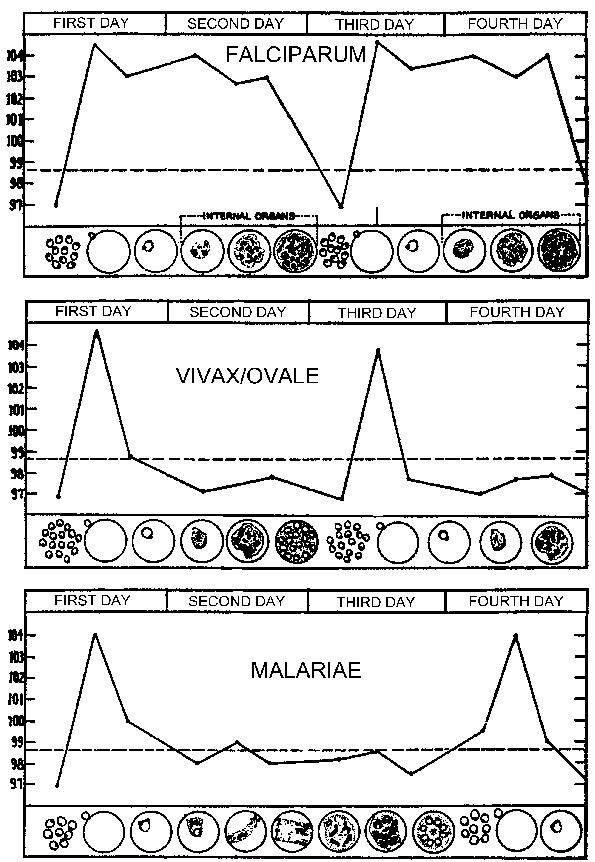
Bu paroksizme görülme süreleri insanların içinde sıtma paraziti senkron gelişme kaynaklanmaktadır. Diğer bir deyişle, bir konak içinde parazitler hepsi schizogony boyunca ilerlerken ile yaklaşık olarak aynı aşamada (örneğin, bir halka, trophozoite, şizont) altındadır. Sıtma atağı enfekte eritrositlerin kopması ve merozoit (yukarıda Şekil) içinden serbest bırakılmasına tekabül. 72 saat periyodiklik S. malarya kan aşamalı schizogony sırasında daha yavaş büyüme ve gelişme kaynaklanmaktadır. Çalışmalar, P. vivax, ateş ve serum TNF-a (tümör nekroz faktörü-alfa) düzeyleri (sağ Şekil) arasında bir ilişki olduğunu göstermiştir.Enfekte eritrosit yırtılır ve TNF-a ve ateşli saldırılara üretimine dönüştüğü zaman Tahminen antijenler veya toksinler serbest bırakılır.
Semptomların paroksizme şiddeti ve süresi türleri (bakınız aşağıdaki Tablo) göre değişir. Genel olarak, hastalığın şiddetine, çeşitli türleri tarafından sergilenen ortalama ve maksimum parazitemya ile ilişkilidir. Plasmodium falciparum diğer türler nadiren ölümcül iken, bir ağır ve ölümcül enfeksiyona üretebilmektedir. Ile enfekte hastalar, P. vivax, özellikle ilk kez, oldukça hasta olabilir. Ancak, P. vivax nadiren ölümle komplikasyonları veya sonuçları neden olur. Fırsat üzerinde çok sayıda organı tutan şiddetli sıtma da not edilmiştir P. vivax (Kochar ve diğerleri, bkz enfeksiyonları (1), Ocak 2005 EID 11). Aktivasyonuna relaps, P. vivax hypnozoites birkaç yıldır oluşabilir. P. ovale

paroksizmleri hafif ve kısa süreli olma eğilimindedir ve nüksedene nadiren bir yıldan fazla İlk enfeksiyondan sonra meydana geldiğini en iyi huylu olduğunu. P. malariae, genel olarak hafif bir hastalığa üretir, ancak ilk paroksizmleri şiddetli orta olabilir. Bu da, çok kroniktir ve recrudescences ilk enfeksiyondan sonra birkaç on yıl belgelenmiştir. Bu kronisite bazen muhtemelen böbrek glomerüllerinde Antijen-antikor komplekslerinin çökelmesi nedeniyle böbrek komplikasyonları ile ilişkilidir. Konak bağışıklık geliştikçe sıtma paroksizmleri dönemlilik az şiddetli ve düzensiz hale gelecektir. Bu dokunulmazlık Ancak enfeksiyon tekrarlamalar veya recrudescences veya haline yeniden virüs sergileyebilir uzun semptomlar ve bireylere göre daha devam bunda bir sterilizasyon dokunulmazlık değildir. Tedavi edilmediği takdirde, sıtma tüm formlar kronik olma eğilimindedir.
| Hastalık Şiddeti ve Süresi | |||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||||||||||||||||||||||||||||||||||||
| Morbidite ve falciparum sıtma ölüm |
|---|
|
Diğer üç türün aksine, P. falciparum ölümlü sonuçları olan ciddi bir hastalık üretebilir. Bu artmış morbidite ve mortalite ile bağlantılı yüksek parasitemias kısmen nedeni, P. falciparum enfeksiyonları. Bunlar potansiyel olarak yüksek parasitemias üretilen merozoitlerin sayıda ve yeteneği payı bulunmaktadır P. falciparum tüm eritrositler işgal etmeye. Bunun aksine, P. Vivax ve P. ovale oysa retikülositleri (yani, olgunlaşmamış eritrositler) tercih S. malariae yaşlanmış eritrositler (tercih tür farklılıkları bakınız). Parazitemisi da hızla nedeniyle cytoadherence ve tutulumuna artırabilir P. falciparum. Dokularda bu ayırma dalak tarafından enfekte eritrositlerin çıkarılması en aza indirir ve daha verimli bir eritrosit istilası .. falciparum malarya, en kayda değerleri, anemi ve serebral malarya ile bağlantılı komplikasyonlara yüksek parazitemi ve tutma sonucu (bir sonraki bölümde ele sağlar). Anemi, kan-aşaması schizogony sırasında eritrositlerin yıkımı kısmen bağlıdır. Ek olarak, non-enfeksiyonlu eritrosit enfeksiyon sırasında daha yüksek oranlarda tahrip ve eritrositlerin bir azalan üretim vardır edilir.
Patogenez ve Şiddetli Sıtma
Tüm sıtma türleri ile bağlantılı patoloji enfekte eritrositlerin kopması ve parazit malzeme ve metabolitler, hemozoin (örneğin, sıtma pigment) ve hücre kalıntılarının serbest ile ilgilidir. Yukarıda ele paroksizme ek olarak, hemozoin birikmesi uzun sıtma, karakteristik bir özellik olarak bilinir. Sindirilen enfekte ve normal eritrosit ve hemozoin ile makrofajlar tarafından kanıtlandığı gibi, retikuloendotelyal sistem artan bir aktivitesi, özellikle karaciğer ve dalak ve böylece genişleme vardır. Hariç P. falciparum sıtma ile bağlantılı patoloji huylu olma eğilimindedir. Çeşitli şiddetli komplikasyonlar en önemli ve sık rastlanan bir ölüm nedeni olan serebral sıtma falciparum sıtma ilişkilendirilebilir.
Serebral malarya, bir bilinç bozukluğu (Kutu) ile karakterize edilir. Ortaya çıkan semptomlar uyuşukluk, kafa karışıklığı ve sonuçta koma izledi şiddetli baş ağrısı vardır. Konvülsiyon da sıkça serebral sıtma ile ilişkilidir. Bu nörolojik belirtiler serebral mikrovasküler enfekte eritrositlerin sekestrasyonuna bağlı olduğuna inanılmaktadır. Haciz hayati organlara, özellikle beyin, akciğer, gut, kalp ve plasentada derin damar yataklarının endotel hücrelerine trophozoite- ve şizont bulaşmış eritrositlerin cytoadherence ifade eder. Bu haciz parazit için birçok avantaj sağlar. önemli bir avantajı dalak kaçınma ve enfekte eritrositlerin sonraki ortadan kaldırılmasıdır. Buna ek olarak, derin dokularda düşük oksijen gerginlikler, daha iyi bir metabolik ortam sağlar.
| Serebral Sıtma |
|---|
|
Cytoadherence enfekte eritrosit yüzeyine elektron yoğun çıkıntılar tarafından aracılık ettiği görülür. Bu ‘düğmeler’ trophozoite ve şizont aşamalarında eksprese edilir ve eritrosit membran ihraç parazit proteinleri sonucu olarak ortaya çıkar.İnsan arasında Plasmodium türleri, topuzlar kısıtlanır P. falciparum ve böylece düğmeleri cytoadherence bir rol oynadığını göstermektedir. Buna ek olarak, hayvan arasında iyi bir korelasyon aynı zamanda orada Plasmodium kolları ve sergi sekestrasyonunu ifade türleri. Elektron mikroskopisi da kolları ile enfekte eritrosit ve endotel hücre arasındaki temas noktası olduğunu gösterir.
| Pf EMP-1 |
|---|
|
Cytoadherence moleküler mekanizması reseptör-ligand etkileşimini içermektedir. Diğer bir deyişle, enfekte eritrosit (ligand) yüzeyi üzerinde eksprese edilen proteinler endotel hücreleri (alıcı) yüzeyi üzerinde eksprese edilen proteinlere bağlanacaktır. Pf EMP-1 (E rythrocyte m zarı böylesine protein) cytoadherence ligandı (Kutu) olarak dahil edilmiş olan bir parazit proteindir. Reseptör-ligand etkileşimleri genellikle oldukça korunmuş doğası constrast, Pf EMP-1, son derece değişken bir elemanı (= olduğunu var 40-50 farklı genlerle) gen ailesi. Reseptörü tanımlanmıştır olarak muhtemelen işlev Çeşitli konak proteinler (aşağıdaki tabloya bakınız). Bu ana proteinlerin çoğu, hücre-hücre etkileşimlerinde işlev ve hücresel yapışma içinde yer alırlar. Çeşitli çalışmalarda farklı ifadesi göstermiştir Pf EMP-1 gen farklı reseptöre bağlanan fenotipleri ile ilişkilidir. Yüzeyi ile ilişkili bu antijenik varyasyon maruz Pf EMP-1, immün sistemden sakınma parazit sağlar. Bununla birlikte, cytoadherence işlevi birden reseptörlerini tanıyan yeteneği (Şekil) üzerinden korunur. Bu antijenik varyasyon aynı zamanda farklı hastalık sonuçlarıyla ilgili olabilir. Örneğin, hücreler arası yapışma molekülü-1 (ICAM-1), genellikle serebral patolojisinde rol oynar.
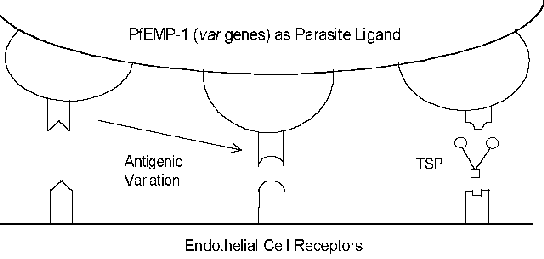
| Olası Reseptörler |
|---|
|
Serebral sıtma patolojinin erken gözlemleri büyük mikrovasküler enfekte eritrositlerin numaraları ve sendromun gelişmesi arasında bir ilişki önerdi. Başlangıçta bu cytoadherence mekanik olarak bloke (yani serebral iskemi) ve daha sonra hipoksi yol açacağını kabul edilmiştir. Buna ek olarak, parazit, aynı zamanda, hipoglisemi ve/veya laktik asidoz lokalize metabolik etkilere neden olabilir. hipoksi ve metabolik etkileri daha sonra koma ve sonraki ölüme neden olur. Ancak, haciz hipotezi ile bazı sorunlar vardır:
serebral sıtma hayatta arasında nörolojik sekellerin:
Van Hansbroek (1997) J. Pediatr. 131: 125 |
- serebral malarya ile bağlantılı koma, tedaviden sonra hızlı bir şekilde tersine çevrilebilir
- hayatta kalan yüksek bir yüzdesi, herhangi bir süreklilik nörolojik komplikasyonlar sahip,
- iskemik hasar olmaması, (ana mekanizma olarak hipoksi dışlamaktadır)
- sekestrasyon da oluşur olmayan serebral malarya.
Bu sorunlar Diğer koma beyin fonksiyonunu etkileyen kısa ömürlü moleküllerinin aracılık ettiği olduğunu ileri sürmüşlerdir.Uygun host aracıları, örneğin TNF-a gibi sitokinleri içerir bir ya da nitrik oksit. Bu sitokin Teorik olarak, sıtma antijenleri TNF kamçılar bir sonra nitrik oksit indükleyen veya diğer patolojik etkilere sahip olabilecek. Nitrik oksit, nöronal fonksiyonu etkilediği bilinmektedir ve aynı zamanda, damar genişletici ile KİBAS’a neden olabilir. Bu sitokinlerin sistemik salınım komaya neden olur, ancak, mümkün olan ve bir de yüksek lokal konsantrasyonlarına neden olur beyinde bu mediyatörlerin salımının varsaymak gerekir. Buna ek olarak, engellenmiş kılcallarla ilgili olarak ortaya az lenfosit infiltrasyonu veya inflamasyon vardır.
Serebral malarya patofizyolojisinden sekestrasyon hipotezi ve sitokin teorisi dışlayan değildir ve her iki fenomen ilgili olma olasılığı vardır. Örneğin, eritrosit kopma salınır parazit ekso-antijenler, TNF-a salgılar için makrofajlan uyardığı bilinir bir. TNF- a, ICAM-1, beyin endotelyal hücrelerinin yüzeyi üzerinde yapışma moleküllerinin ekspresyonunu yukarıya doğru düzenlemek üzere bilinmektedir. Bu enfekte olmuş eritrositlerin bağlanmasını artırmak ve vasküler tıkanma, çözünür aracıları, metabolik etkiler, veya bir kombinasyonu (Şekil) bağlı olup olmadığını etkilerini artırmak için, yol açar.
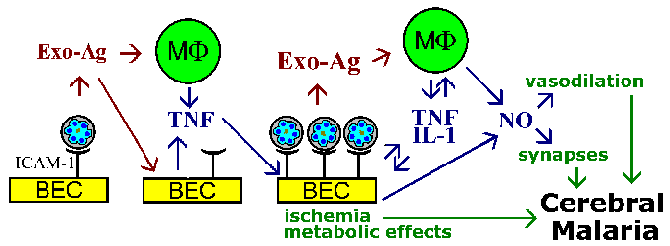
Özetle:
- P. falciparum şiddetli ve ölümcül hastalığa neden olabilir
- Bu ilgilidir diğer insan sıtma ile karşılaştırıldığında patojeniteleri arttı P. falciparum en:
- yüksek üreme kapasitesi
- cytoadherence ve haciz
- Sekestrasyon dalak kaçınma ile daha yüksek verimlilik kapasitesine katkıda
- Ayrıca lokal patolojik etkilere sahip olabilir endotel hücreleri ve özellikle cytoadherence muhtemelen serebral malarya katılır
- Serebral malarya patofizyolojisi tam olarak anlaşılamamıştır, fakat büyük olasılıkla konak ve parazit arasında birden fazla faktörü ve karmaşık etkileşimleri gerektirir değildir
Şiddetli sıtma ve patogenezi üzerine Yorumlar:
- IA Clark, WB Cowden (2003) falsiparum malarya patofizyolojisi. Farmakoloji ve Tedavi 99, 221-260.
- R Idro, NE Jenkins CRJC Newton (2005) patogenezi, klinik özellikleri ve serebral sıtma nörolojik sonuçları. The Lancet Neurology 4, 827-840.
- CL Mackintosh, JG Beeson, K Marsh (2004) Klinik özellikler ve şiddetli sıtma patogenezi. Parazitoloji 20, 597-603 Eğilimler.
- Bir Trampuz, K Jereb, ben Muzlovic, RM Prabhu (2003) Klinik incelemesi: Şiddetli sıtma. Kritik Bakım 7, 315-323.
Epidemioloji
| Ilgili bölüme gidin: |
Sıtma öncelikle tropik ve tropik altı bir hastalıktır ve Afrika, Asya ve Güney ve Orta Amerika’nın sıcak nemli bölgelerde yaygındır. Hastalık ayrıca ABD, Avrupa ve Kuzey Avrasya ve Asya dahil olmak üzere birçok ılıman bölgelerde yaygın, ama kökü kurutulmuştur. Daha önce kontrol altında sıtmaya vardı birçok alanda bir canlanma yaşıyoruz (bakınız makaleyi Atlantik). Dört insan sıtma türleri, üst üste binen bir coğrafi dağılımı (Tablo) bulunmaktadır. P. vivax ve P. falciparum ile en sık karşılaşılan türdür P. vivax coğrafi en yaygın olma. Karışık enfeksiyonlar endemik bölgelerde yaygındır. Moleküler yöntemler önermek olduğunu P. malariae ve P. ovale önceden düşünce daha yaygın ve yaygın olabilir (Mueller ve diğerleri, bkz ..: 278 Tr Parasitol 23, 2007).
Coğrafi Dağılımları
vivaks |
falciparum |
malariae |
ovale |
|
|
|
|
| Sıtma Epidemiyolojisi |
|---|
kararlı veya endemik malarya
kararsız veya salgın sıtma
|
Sıtma epidemiyolojisi sabit (veya endemik) ya da stabil olmayan (ya da bir salgın) olması bakımından incelenebilir. Kararlı sıtma birkaç yıl içinde doğal iletim ölçülebilir bir insidans orada olduğu bir durumu ifade etmektedir. Bu aynı zamanda mevsimsel iletimini deneyim alanları yer alacak. Farklı alanlarda insidans hızlarının farklı seviyelerde yaşayabilirsiniz ve bu genellikle ile gösterilir: hypoendemic mesoendemic, hiperendemik ve holoendemic. Çok endemik bölgelerde yaşayan kişiler genellikle bağışıklık yüksek düzeyde sergiler ve iyi enfeksiyonu tolere.
Kararsız ya da salgın, sıtma, daha önce sıtma olmayan ya da bağışıklık kişiler arasında düşük endemik bölgelerde sıtmanın bir artışa veya alanları salgınlara gelir. Bu salgınları çoğu zaman çevre üzerindeki insan davranış değişiklikleri ya da etkilere atfedilebilir. Örneğin, insan göç ve yerleşim bir alana sıtma tanıtmak ve endemik iletim için önceden bağışık olmayan nüfusu ortaya ya. doğal afetler veya kamunun neden ekoloji değişiklikler böyle de sıtma iletimini etkiler ve salgın yol açabilir yol inşaatında gibi projeleri çalışır.
| “Sıtma hakkında her şey bu yüzden bin epidemiyolojik bulmaca olur yerel koşullara göre dökülmüştür.” (1937) Hackett’ın |
Yukarıdaki alıntı sıtma karmaşıklığını vurgular ve birçok hastalık sergiler facets. Farklı topluluklar farklı bir sıtma yaşayacaksınız ve sonuç farklı kontrol ve tedavi stratejileri gerekli olabilir. Ev sahibi, parazit ve vektör arasındaki girift etkileşimler bu epidemiyolojik karmaşıklığı önemli faktörlerdir.
Örneğin, tüm vektör bulaşan hastalıklar gibi, parazit iletimi için fırsatları en üst düzeye konak içinde kronik enfeksiyon kurmak mümkün olmalıdır. Bu mevsimsel iletim durumunda ve düşük endemik bölgelerde özellikle doğrudur. Ve genel malarya enfeksiyonlarına daha uzun bir nispeten asemptomatik kronik faz ile birlikte bir başlangıç akut faz ile karakterize edilir. Bu bağışıklık sistemi tarafından tam boşluğunu önlemek için parazitin kabiliyetlerine bağlıdır. Örneğin, P. falciparum bir sergiler antijenik varyasyon öncesinde bağışıklık sisteminin bir adım sağlar. Buna ek olarak, P. Vivax ve P. ovale hypnozoite aşamasını gösteren ve nükslerin yeteneğine sahiptirler. Bu enfeksiyon kan aşaması temizlenmiş sonra bile insanların içinde enfeksiyon korumak için parazit verir. Bazı relapslarla arasındaki göreceli uzun süre P. vivax izole eder muhtemelen bazı ılıman iklimlerde iletim döngüleri devam ettirebildiği açıklar.
Çeşitli moleküler epidemiyolojik çalışmalar göstermiştir P. falciparum da uzun vadeli kronik enfeksiyon (aşağıda Röper ve arkadaşlarına bakınız) üretebilir.
Röper ve arkadaşları, (1996) AJTMH 54: 325
|
|
||||||||||||||||||||||||
Konak açısından, insanlar parazit için tek önemli rezervuar ve sürekli iletim enfekte bireyler ve insanlar ve anofel cinsi sivrisinekler arasındaki temasın bir havuz bakımı bağlıdır. Birçok faktör enfeksiyona insanların duyarlılığını etkilemektedir. Açıkçası bireyin bağışıklık durumu ve sıtma ile önceki deneyim enfeksiyonunun seyrini etkileyecektir. Enfeksiyon ve yüksek parasitemias görülme sıklığında artış gösterdiği gibi Hamile kadınlar, özellikle ilk gebelik sırasında, sıtma falciparum’a karşı daha hassastır. Buna ek olarak, belirli bir genetik hastalıklar ve polimorfizm azalma enfeksiyon veya hastalığın ile ilişkilendirilmiştir (bakınız Doğuştan direnç).
Sivrisinek potansiyel bir vektör sporogony, sivrisinek bolluk desteklemek için yeteneğine bağlıdır olarak görev yapar ve her türlü iklim ve ekolojik faktörleri (Tablo) etkilenmiş olan, insanları ile temas. Sporogony destekleme yeteneği olmayan tüm türler bu türler üzerine büyük ölçüde bağlıdır Anopheles duyarlıdır Plasmodium enfeksiyonu. Sıcaklık ve sivrisinek uzun ömür vektörü ile parazitin etkileşimini etkileyen diğer önemli faktörlerdir. P. falciparum’un geliştirilmesi 20 Co en az bir sıcaklık gerektirir diğer türler için minimum sıcaklık 16 Co ise, sıcaklık da sporogony süresi daha yüksek sıcaklıklarda önemli ölçüde daha kısa olmasıyla geliştirme süresini etkiler. Sporogony Daha kısa süreli sivrisinek kendi ömrü içinde enfeksiyon iletecektir olasılığını artırır.
Vektörel Kapasitesi Etkileyen Faktörler |
||||||
|---|---|---|---|---|---|---|
|
Sivrisinek yoğunluğu ve beslenme alışkanlıklarının da sıtma iletimini etkiler. insan-sivrisinek temas sivrisinek davranışlarından etkilenecektir oysa Sivrisinek yoğunluğu, sıcaklık, yükseklik, yağış ve üreme yerlerinden kullanılabilirliği etkilenir. Örneğin, belirli bir sivrisinek türleridir anthropophilic olan derecesi sivrisinek olasılığı enfekte olma ve daha sonra başka bir insana enfeksiyon bulaştırma etkileyecektir.yoğunlukları, yüksek seviyelerine ulaşmak ya da tercih edilen hayvan kaynaklı azalmış ise bu anthropophilic eğilimler insanlara geçecektir birçok zoofilik sivrisinek zorunlu olarak mutlaktır. Tercih edilen besleme süresi ve sivrisinek iletim dinamikleri etkileyecektir ağırlıklı iç veya dış beslenir olup. Örneğin, açık besleme sivrisinekler çoğu insan içeride olduğunda gece geç besleyen daha erken akşam bir insan kanı yemek bulmak için daha olasıdır. Sivrisineğin davranışları da kontrol faaliyetleri dikkate alınması gerekmektedir.
| “Paradoksal olarak, çocukluk döneminde şiddetli hastalık riskleri en yüksek nakil yoğunluklarına sahip popülasyonlar arasında en düşüktür ve en yüksek hastalık riski iletim, düşük-orta yoğunluklarına maruz kalan popülasyonlar arasında gözlendi.” Snow ve diğerleri (1997) Lancet 349: 1650 |
Dokunulmazlık
Endemik bölgelerde yaşayan kişiler sıtmaya karşı bağışıklık gelişir yapmak. Hemen hemen her zaman bir kişinin sıtma onların başlangıç açılmaları sırasında semptomları göstermez.sıtma sonraki pozlama ile ilişkili semptomlar olsa genellikle daha az ciddidir. Sıtmaya karşı bağışıklık geliştirmek için yavaş ve birden fazla poz gerektirir. Çok endemik bölgelerde sadece küçük çocuklar büyük çocuklar ve yetişkinler esasen ağır hastalık ve ölüm korunur oysa şiddetli falciparum sıtma gelişmekte olan yüksek risk altındadır. Ancak, bu dokunulmazlık hala enfekte olabilir o kişiler bir sterilizasyon dokunulmazlık değildir. Buna ek olarak bağışıklık kısa ömürlü ve bağışıklık seviyesi azalır defalarca maruz kalmaya yokluğunda icra edilmektedir. Örneğin, Daha önce yarı bağışıklık yetişkinler genellikle 1-2 yıldır olmayan bir endemik bölgede kaldıktan sonra endemik bölgelerden döndükten sonra şiddetli sıtmaya gelişecektir. Kısmi bağışıklık Bu durum içinde parazitemi indirilir fakat ortadan kalkmış ve parazitemi daha iyi tolere edilir (Şekil) bazen premunition olarak adlandırılır. Premunition patojen mevcut olması üzerine şarta bir bağışıklık belirtmektedir.
Bağışıklık yanıtı parazitin yaşam döngüsünün öncesi eritrosit veya eritrosit aşamalarda ya yönelik olabilir. Ancak, yaşam döngüsünün eritrosit aşama muhtemelen parazit temizleme ve hastalık azaltma açısından son derece önemlidir. Bağlı parazit ya da bunun eritrosit yüzeyindeki HLA moleküllerinin eksikliğine genellikle antikorun kan aşamalı bağışıklık önemli bir rol oynadığı varsayılmaktadır. Antikor için olası efektör mekanizmaları:, eritrosit yüzeyinde açığa antijenleri Parazit antikorların bağlanma için eritrosit merozoit tarafından istila, cytophilic antikorların aracılık ettiği antikora bağımlı hücre öldürme ya da enfekte eritrositlerin artan açıklığını bloke eder. Bunların hepsi alt parasitemia sonuçlanacaktır. Bu çeşitli mekanizmaların nisbi önemi açık değildir ve muhtemelen bağışıklık muhtemelen sayısız hedeflere karşı antikorların üretilmesini gerektirmektedir. Birçok antijenik varyasyon ve polimorfizmleri ile birlikte bu, Plasmodium antijenler, bağışıklık yavaş gelişimini açıklayabilir.
Asemptomatik bireylerin parazitemi yüksek seviyeleri sergileyebilir gözlem ‘karşıtı hastalık bağışıklık’ kavramına yol açmıştır. Bu, daha az parasitemias ile sonuçlanan, yukarıda ele alınan ‘anti-parazit’ bağışıklık ek olacaktır. Şiddetli sıtma ve ölüm, TNF-a ve diğer ön-iltihaplanma sitokinleri ile ilişkilidir. Için tarif edildiği gibi paraxoysms ve serebral sıtma inflamatuar öncesi sitokinlerin üretimini teşvik edebilir enfekte eritrosit tarafından yayınlanan, antijenler veya toksinler. Bu ekso-antijenlere karşı antikorlar muhtemelen toksik etkilerini nötralize etmek ve böylece bir anti-hastalık bağışıklığa yol olabilir.
Sıtma için Dokunulmazlık Hakkındaki gözden geçirin:
J Langhorne, FM Ndungu, AM Sponaas, K Marsh (2008) sıtma için bağışıklık: cevaplardan çok sorular. Nature Immunology 9, 725-732.
Çünkü başka yollarla sıtmayı kontrol edilmesinde zorluklar sıtmaya karşı bir aşı geliştirilmesinde büyük yarar vardır. Şu anda hiçbir piyasadaki aşı yoktur, ancak aşı adayları belirleme ve güvenlik ve etkinlik için potansiyel aşılar test yönelik önemli bir araştırma çabası yoktur. Parazitin karmaşık yaşam döngüsü ve biyoloji birçok potansiyel hedefleri (Tablo 15.9) sağlar. Örneğin, Sporozoitin veya exoerythrocytic aşamada karşı aşılama enfeksiyonu önleyebilir. Tek Sporozoitin kaçış kan aşamalı enfeksiyonuna ve hastalığa yol açacak Ancak, indüklenmiş bağışıklık tamamen etkili olması gerekir. Aşılar merozoit karşı hedefli veya enfekte eritrosit merozoit istilası müdahale veya enfekte eritrositler giderilmesi saglar parasitemia düşürecektir. Etkili tamamlanmadı olsa bile bu tür bir aşının sıtma ilişkili patogenezi kadar azaltabilir. Buna ek olarak, enfeksiyon bağışıklık tepkisini artırmak için hizmet edebilir. Potansiyel olarak toksik antijenlere karşı bağışıklık kazandırmak suretiyle hastalığa karşı aşılama mümkün olabilir. Bir proinflamatuar bağışıklık tepkisini uyaran antijenleri etkisiz hale Antikorlar sıtma ile ilişkili patogenezinde bazı azaltabilir. Böyle gametositlere ve gametlerin olarak parazitin Cinsel aşamaları da hedeflenebilir. Gamet antijenlere karşı yöneltilen antikorlar sivrisinek ve sporogony enfeksiyonu önleyebilir. O hastalığa karşı bireyi korumak, ancak iletim düşürerek toplum içinde başkalarını korumak olmaz böyle bir aşı fedakar olurdu.
| Potansiyel Aşı Stratejileri | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
İnsan Genetik ve Doğuştan Direnç
| Doğuştan Direnç |
|---|
|
Bazı genetik hastalıklar ve polimorfizm azalma enfeksiyonunun veya hastalığının (Kutu) ile ilişkilendirilmiştir. Örneğin, Duffy kan grubu antijeni eksikliği bireyler dirençli olan, P. vivax. Batı Afrika’da nüfusun büyük bir bölümü böylece düşük düzeyde muhasebe Duffy negatif P. vivax batı Afrika. Bu doğal direnç merozoit istilası için eritrosit reseptörü olarak Duffy antijenin belirlenmesine yol açmıştır. (Bkz reseptör-ligand etkileşimlerini merozoit işgali sırasında).
Çeşitli kalıtsal eritrosit bozuklukları ağırlıklı sıtma endemik bölgelerde ve beklenenden çok daha yüksek frekanslarda bulunurlar. Bu durum, bu bozukluklar sıtmaya karşı koruma sağlamak olduğunu spekülasyonlara yol açmıştır. Örneğin, güneydoğu Asya ovalcytosis nedeniyle Bu mutasyon daha sert ve işgali Merozoit daha dirençli hale eritrosit membranı neden bant 3. adlandırılan bir eritrosit membran proteini bir mutasyon etmektir. Diğer hastalıklar sıtmaya karşı koruma sağlayabileceğini mekanizma (lar) bilinmemektedir. Çoğu durumda bu varsayılan veya kusur ve enfeksiyon kombinasyonu erken liziz veya enfekte eritrositin temizlenmesine yol olduğu düşünülmektedir. Örneğin, glukoz-6-fosfat dehidrogenaz (G6PD) eksikliği olan eritrosit oksidatif stres ele da bozukluk (bakınız Uyuşturucu Eylem). Parazit metabolizması ve hemoglobin sindirim sonucu üretilen ek oksidanlar (bakınız Biochemistry Notlar enfekte eritrosit bastıran ve parazit schizogony tamamlayabilir önce, tahrip olmasına neden olabilir). Orak hücreli anemi ve talasemi da oksidatif strese karşı enfekte eritrosit daha duyarlı hale getirmek için spekülasyonlar vardır.
Kırmızı kan hücresi polimorfizmleri ve sıtma ile ilgili yorumlar:
- G Min-Oo P Gros (2005) Eritrosit varyantları ve bunların sıtma koruyucu etkinin doğasına bağlıdır. Hücresel Mikrobiyoloji 7, 753-763.
- TN Williams (2006) İnsan kırmızı kan hücresi polimorfizmleri ve sıtma. Mikrobiyoloji 9, 388-394 Current Opinion in.
- TN Williams (2006) Alyuvar kusurları ve sıtma. Moleküler ve biyokimyasal Parasitology 149, 121-127.
ABD’de Sıtma
Sıtma önce Kuzey Amerika ve Avrupa’da dahil ılıman bölgelerde daha yaygındı. Sıtma Avrupalı sömürgeciler (tarafından Amerika’da tanıtıldı inanılmaktadır P. vivax ve P. malariae) ve Afrika köle ( P. falciparum) 16. ve 17. yüzyıllar boyunca. Sıtma çöller ve dağlık alanlar ve muhtemelen 1875 civarında zirve yaptı insidansı hariç ABD’nin bazı bölgelerinde endemik hale kentsel alanlarda ve tarlalara, geliştirilmiş konut ve beslenme oluşturmak için bataklık drenaj, daha iyi sosyoekonomik koşullara ve standartlarına kırsal A nüfus kayması yaşam, sağlık hizmetlerine daha fazla erişim ve tedavi için kinin mevcudiyeti tüm hatta belirli kontrol önlemleri (Kutu) yapılmaya başlamasından önce sıtma yaygınlığı düşüşe katkıda bulunmuştur. Böyle vakası tespiti ve tedavisi, Larva mücadelesi ve ev ilaçlama gibi bazı kontrol faaliyetleri, 1940 yıllarda tanıtıldı ve ABD’de sıtma eradikasyonu yönetiliyordu. 1950 yana ABD’de sıtma neredeyse tüm vakalar aktarıldı.
Sıtma endemik olduğu ülkelere seyahat ederken ABD’de tanısı sıtma vakalarının büyük çoğunluğu kişiler tarafından elde edilir. Bununla birlikte, 1990 sırasında ABD (de yerli sıtma iletim çeşitli salgınları vardı Zucker, 1996). Bu salgınlar yoğun nüfuslu bölgelerde ve göçmenlerin çok sayıda ile ilişkiliydi. Vakaların% 80’inden fazlası vardı P. vivax. Buna ek olarak, salgınlar böylece enfeksiyon sporozoitlerin geliştirilmesi için izin anopheline türü hayatta kalma oranları ve sporogonic çevrim süresini azaltabilir çok sıcak ve nemli hava ile ilişkilidir. (Yerel olarak edinilmiş yedi durumlar hakkında da son raporunu görün P. vivax, Temmuz-Ağustos 2003 döneminde Florida’da meydana gelen sıtma MMWR 52: 908).
| ABD’de sıtma iletiminde bir azalmasına yol açan faktörler |
|---|
|
Önleme ve Kontrol
Sıtma önlenmesi ve kontrol edilmesi için Stratejiler üç farklı yaklaşımlar (Kutusu bakınız) içerir. Bireylerde sıtma önlenmesi, genel bednets, koyucular, vb kemoprofilaksiye (kullanımı yoluyla insan sivrisinek temasın azalması içerecektir aşağıya bakınız özellikle seyahat halinde de kullanılabilir). Ancak sadece kemoprofilaksi parasitemia bastırır ve enfeksiyonu önlemez.
Topluluk düzeyinde Kontrol faaliyetleri doğrudan bir alanda sivrisinek sayısını azaltacak yaklaşımlar yanı sıra insan-sivrisinek temasını azaltmak yaklaşımları yararlanabilirler. Bu yaklaşımlar, sivrisinek üreme alanlarına (örneğin, çevresel dönüşümü) içinde azalma, kimyasal ya da biyolojik maddeler ve yetişkin sivrisinekler için püskürtme büyük bir insektisit ile larva evreleri hedefleyen. Biyolojik kontrol yöntemleri sivrisinek larvaları veya bakteri yemek balık eklemekte, (örneğin Bacillus thuringiensis) Larva toksinler salgılamak olan. Örnek tespit ve tedavi bir başka muhtemel kontrol yöntemidir. Enfekte kişilerin, özellikle asemptomatik bireyleri, belirlenmesi ve tedavi edilmesi insan nüfusunun içinde parazit rezervuar boyutunu azaltacaktır ve şanzıman oranlarını düşürebilir. Ancak, bu nispeten pahalı bir yaklaşım olabilir.
Bu yaklaşımlar birbirini dışlayan değildir ve kombine edilebilir. Başarılı kontrol programlarının çoğu sivrisinek ve enfekte kişilerin tedavisini kontrol tedbirleri ikisini de içerir. Evrensel etkili olduğu kanıtlanmıştır sıtma kontrolünün standart bir yöntem yoktur. Belirli bir bölgenin, epidemiyolojik sosyoekonomik, kültürel ve altyapı faktörlerin en uygun sıtma kontrol belirleyecektir. dikkat edilmesi gereken faktörlerden bazıları şunlardır:
- Varolan sağlık hizmetleri ve diğer kaynakların altyapı
- Iletim yoğunluğu ve periyodik (örneğin, mevsimsel)
- Sivrisinek türleridir (ekolojik şartlar, davranış özellikleri, insektisit hassasiyet, vs.)
- Parazit türü ve ilaç duyarlılıklar
- Nüfusun kültürel ve sosyal özellikleri
- Sosyal ve ekolojik değişimin varlığı
Tropikal Afrika’da sıtma kontrolü nedeniyle yüksek iletim oranları ve genel düşük sosyoekonomik seviyenin özellikle sorunlu olmuştur. Çeşitli çalışmalar, böcek öldürücü içeren cibinlikler (ITBN) sıtma ile ilişkili morbidite ve mortaliteyi azaltmak olduğunu göstermiştir. Çoğu alanda bednets tanıtılması büyük promosyon programları gerektirmeyen ve kullanımları kolayca kabul edilir. Bunun nedeni sivrisinek sıkıntı ısırma azalma kısmen olabilir. Bazı sorular bednet programlarının ekonomik sürdürülebilirliği açısından tereddütler bulunmaktadır. Periyodik böcek ilacı ile cibinlik yeniden tedavi etmek gereklidir ve bunlar yırtılmış olur ve yıpranacaktır olarak cibinlikler tamir ve değiştirilmesi gerekebilir. Ayrıca, bazı onlar maruz kalmayı azaltmak, ancak bunu ortadan kaldırmak olmadığı bednets uzun vadeli yararları hakkında endişeleri artırdı.
Sıtma kumanda üzerindeki [İnceleme: RS Phillips (2001) kontrolü için sıtma ve potansiyelin mevcut durumu. Clin.Microbiol. Rev. 14: 208].
Insan sivrisinek teması azaltmak
- emprenye cibinlikler
- kovucular, koruyucu giysi
- ekranlar, ev püskürtme
Vektör yoğunluğunu azaltmak
- çevresel modifikasyon
- larvisitler/böcek
- biyolojik kontrol
Parazit rezervuar azaltmak
- durum tespit ve
- kemoprofilaksiye
Teşhis
|
Sıtma Endemik bir bölgede olmak ve sıtma ile tutarlı semptonlardı öyküsü olan kişilerde şüphelenilen (bkz KLİNİK).Özellikle enfeksiyon erken dönemlerinde Bu belirtiler, spesifik olmayan ve çoğu zaman grip benzeri olarak tarif vardır. Hastalık ilerledikçe, hasta, dalak büyümesi ve/veya karaciğer ve anemi sergileyebilir. Tanı mikroskopik olarak teyit edilir. Ince leke türleri tanımlanması için tercih edilir iken, kalın kan lekeleri, genel parazit saptanması için daha duyarlıdır. (Bkz kan aşamalı morfolojisi arasında Plasmodium türleri.) O bu süre 48 saat boyunca ek smear 6-12 saat yapılması tavsiye edilir yayma parazitler birinci kan bulunamazsa. Bir geçici tanı P. falciparum (münhasıran sayıda ve aşamaları halka) özellikle olmayan bir bağışıklık bizzat bir tıbbi acil durum teşkil edebilir. Antijen tespitine dayanan hızlı immünokromatografik test (örneğin, daldırma çubukları) (de mevcuttur bkz:).
Kemoterapi ve ilaç direnci
Çeşitli Sıtma ilaçları mevcuttur. Birçok faktör sıtma için en iyi tedavi karar vermek hakkına sahiptir. Bu faktörler parazit türler, hastalığın şiddetini (örn., Karmaşık), hastanın yaşı ve bağışıklık durumu, ilaçların (yani için parazitin duyarlılığı kapsamaktadır ilaç direnci) ve maliyet ve ilaçların elde edilebilirliğini. Bu nedenle, kesin öneriler coğrafi bölgeye göre değiştirecektir. Buna ek olarak, çeşitli ilaçlar farklı yaşam döngüleri (Tablo) üzerine farklı şekilde davranabilirler. Ilgi Diğer bağlantılar:
- Drug Action ve direnç mekanizması
- Sanal Deniz Hastanesi, hakkında bilgi tedavisi ve antimalaryel
- WHO, kılavuz karşıtı malalarial kullanım
- Tıbbi Harf makale Parazit Enfeksiyonlarının için İlaçlar
| Seçilmiş Antimalaryal İlaç | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Parazitin kan aşamasında üzerine hareket kan schizontocides, Hızlı tepkili, akut enfeksiyonları tedavi etmek ve hızlı bir şekilde klinik semptomları hafifletmek için kullanılır. Klorokin genellikle hastalar için tavsiye edilen tedavidir, P. vivax, P. ovale, P. malariae’nm ve komplikasyonsuz klorokin duyarlı P. falciparumenfeksiyonları. Klorokin güvenli ve genellikle iyi tolere edilir. Yan etkiler, pruritus (yani, kaşıntı), bulantı ya da ajitasyon içerebilir. Ya bulaşmış hastalar P. vivax veya P. ovale, Yeniden enfeksiyon için yüksek risk altında değildir ve bu, aynı zamanda primakuin ile (bir doku schizontocide) tedavi edilmesi gerekir. Primaquine hypnozoites (tekrarlamalar bakınız) dahil olmak üzere parazitin karaciğer aşamasında, karşı etkilidir ve gelecekteki relaps önleyecektir. Klorokin ve primakuin kombinasyonu genellikle ‘radikal tedavi’ olarak adlandırılır.
Şiddetli veya komplike, falciparum sıtma yüksek mortalite ile ciddi bir hastalıktır ve hayatı tehdit olarak kabul edilmelidir ve bu nedenle acil tedavi gerektirir. Tedavi tipik olarak ağızdan ilaç alamaz bu nedenle hastalar genellikle koma veya kusma olduğu için parenteral ilaç verilmesini (yani, enjeksiyonlar) gerektirir, ve. Parenteral formülasyonlar klorokin, kinin, kinidin ve artemisinin türevleri için kullanılabilir. Artemisinin türevleri genellikle tercih seçimdir, ama henüz her yerde onaylanmamıştır. Örneğin, Amerika Birleşik Devletleri kinin ve kinidin şiddetli sıtma için onaylanmış ilaçlardır. Hastalar sürekli tedavinin seyri sırasında hematokrit, parazitemili hidrasyon seviyeleri, hipoglisemi ve ilaç toksisitesi ve diğer komplikasyonların belirtileri açısından izlenmesi gerekir. Oral uygulama için bir anahtar kısa sürede hasta yapabiliyor olarak yapılmalıdır. Şiddetli sıtma için ölümlerin çoğu meydana veya hasta hastaneye alınamaz durumlarda eve yakın. Köy sağlık çalışanları tarafından uygulanabilir artemisinin fitiller de geliştirilmiştir ve güvenli ve etkili olduğu kanıtlanmıştır.
Klorokin etkinliği büyük ölçüde geniş yayılma klorokin direnci azalır P. falciparum ve klorokin’e dirençli ortaya çıkması, P. vivax. Klorokin tedavisi klorokin’e dirençli sıtma bir alanda etkili olan veya, eğer değilse, ortak bir alternatif tedaviler, meflokin, kinin, doksisiklin veya Fansidar® ile kombinasyon halinde kullanılabilir. Artemisinin (dihidroartemisinin artesunat ve artemeterin) türevleri giderek Asya ve Afrika’da kullanıldığı ve şimdi Dünya Sağlık Örgütü tarafından tedavinin ilk satırı olarak tavsiye edilmektedir. Bu ilaç, başlangıçta pelin bitkiden elde edilmiştir (Artemesia annua) Ve bitki çayı ateşli hastalıkların tedavisinde quinhaosu denilen Çin’de uzun süredir kullanılmaktadır. Artemisinin türevleri ile ilişkili yüksek açılma oranları önlemek ve tedavi, ilişkisiz, malarya hastalığını önleyici ile kombine edilmesi önerilir ilaç direncinin gelişiminin yavaşlatılması için. Artemisinin ile kombinasyon halinde kullanılan ilaçlar meflokin, lumefantrin, Fansidar® ve amodiakuin içerir.
Kemoprofilaksi. Kemoprofilaksi sıtma endemik bölgeleri ziyaret olmayan sıtmalı bölgelerden gelen kişiler için özellikle önemlidir.Böyle olmayan bağışıklık kişiler hızla ciddi ve hayatı tehdit eden bir hastalık gelişebilir. Tedavinin durumunda olduğu gibi hiçbir standart öneri ve koruyucu ilaç tedavisi seçimler seyahat ve indivdual kişiyle ilişkili koşullar yüksek ölçüde bağlıdır. (CDC Tanıtım Dosyası görün Sıtma Önleme bu ilaçlar, uzun kullanım süreleri boyunca alınan anlaşılmalıdır.) Kemoprofilaksi toksik olmayan ilaçların kullanılmasını gerektirir. Genellikle hasta seyahate çıkmadan önce ilacı alıp sonra endemik bölgede konaklama sırasında ilacı almaya devam ve döndükten sonra ilacı almaya devam başlayacaktır. Bu ilaç ziyareti dışarı boyunca yeterli düzeyde tutulur sigorta ve ziyaret sırasında elde edilen herhangi bir enfeksiyona karşı korumaktır. Ne yazık ki, etkili ve toksik olmayan ilaçlarla (örneğin, klorokin, primetamin, proquanil) pek çoğu ilaç direncinin sınırlı kullanılırlar. Başka bir strateji, profilaksi ile birlikte kullanılmak üzere olası (veya ‘bekleme’) tedavisidir. Bu durumda, bir kişi profilaksisi forgoes ya da profilaksisi için klorokin veya başka göreceli olarak toksik olmayan, ilacı alır ve Fansidar gibi bir ilaç taşıyan.
Sıtma kemoprofilaksiye için meflokine kullanımı biraz tartışmalıdır. Meflokin tek haftada yaptığı ile böylece sıtma önlenmesi günlük uygulanması gerekir ilaçlara avantajlar sunan en etkilidir. Bu dozda Meflokin çoğu bireyler tarafından tolere edilir. Ancak, bazı insanlar olumsuz nöropsikiyatrik uyku bozuklukları ve kabuslar olarak etkiler tecrübe. Bu stresli bir olaydır uluslararası seyahat ile şiddetlenir olabilir., Randomize kör ve kontrollü denemeler olumsuz nöropsikiyatrik diğer antimalaryel ile daha meflokine sadece biraz daha yüksektir etkilediğini göstermektedir.
Exoerythrocytic aşama (yani, karaciğer) Öldürme kan enfeksiyonu önleyecek ve nedensel profilaksi olarak bilinir. Bu profilaktik ilaç önce alınması gereken süreyi sınırlandırır ve bir endemik olduğu bölgeye seyahat sonrası son derece arzu edilir. Nedensel profilaksisi için piyasada bulunan tek ilaç primakuin olduğunu. Ancak, sıtma profilaksisi primakuin onaylı kullanımı değildir ve sadece bir vaka ile ayrı ayrı profilaksisi için reçete edilmelidir. Örneğin, insanlar için sık sık yüksek endemik bölgelere kısa süreli geziler ve kişi glikoz-6-fosfat dehidrojenaz eksikliği sergileyen etmediğini kim. Tafenoquine anda nedensel profilaksisinde kullanımı için saha araştırılmaktadır.
Sıtma tedavisinde Yorumlar:
- Pasvol G (2006) karmaşık ve şiddetli sıtma tedavisi. Br Med Bull 75-76: 29-47.
- Newton P Beyaz NJ (1999) Sıtma: tedavisi ve önlenmesinde yeni gelişmeler. Annu Rev Med 50: 179.
- Beyaz NJ (1996) malaryanın tedavisi. N Engl J Med 335: 800.
- Beyaz NJ (2008) Qinghaosu (Artemisinin): Başarı fiyatı. Bilim 320, 330-334.
İlaç direnci
İlaç direnci ve özellikle de, klorokin dirençli sıtma kontrolünde önemli bir halk sağlığı sorunudur. İlaç direnci tedavi başarısızlığı ile tanımlanır ve tedavi (Şekil) aşağıdaki nüksetmesi zamanına bağlı olarak farklı seviyelerde gruba ayrılır. Geleneksel ilaç direnci, bu düzeyleri duyarlı (bir nüksetmesi) olarak tarif edilmiş olup, RI (gecikmiş recrudescence), FcyRII (erken açılma) ve FcyRIII (çok az ya da hiç anti-parazit etkisi). Klinik sonuca göre bir değiştirilmiş usül, aşağıda tanımlanan şekilde direnç seviyesi yeterli klinik yanıt (ACR), geç tedavi başarısızlığı (LTF), veya erken tedavi başarısızlığı (BYF) olarak ifade edilir, bu protokolde, 1996 de WHO tarafından tanıtılan:
- ACR, takip 14. günde (bakılmaksızın parazitemi) klinik belirtilerin (bakılmaksızın ateşin) parasitemi veya yokluğu
- LTF, semptomların yeniden ortaya veya takip günlerde 4-14 sırasında parasitemia varlığı
- Takip ilk 3 günü boyunca ETF, parasitemia varlığında klinik belirtilerin sebat
Her iki protokol ilaç direncini belirlemek için kullanılabilir, ancak nüksetmesi ve burada klinik semptomlarının yokluğunda parazitemi yaygındır den yeniden enfeksiyon ayırt etmek zor olabilir burada klinik sonuç protokolü yoğun iletim alanlarda daha pratiktir. Her iki protokol ile ilaç direnci hasta hastaneye ve izlenmesi sırasında ve standart ilaç tedavisini müteakip olan in vivo testleri ile tespit edilir. Karşı ilaçların etkinliğini belirlemek ilaç direnci düzeyini tahmin edilebilir in vitro testlerde de vardır P. falciparum (bakınız kültürde büyümüş İlaç direnci Sıtma DSÖ’de). Konak bağışıklık ve diğer faktörler, in vivo sonuçlarını etkileyebilir çünkü in vivo ve in vitro testler her zaman karşılık gelmez. Ilaç direncinin (bakınız ilişkili olabilir spesifik mutasyonların belirlenmesi başka bir sayfada Tablo) moleküler markörler göre testlerin gelişmesine neden olabilir.
Azalmış duyarlılığı olan parazitlerin aracılığıyla madde basınç altında seçilir sıtma önleyici zaman İlaç direnci geliştirir. Azalmış ilaç duyarlılığı, birkaç mekanizma ile sağlanan (bkz DİRENÇ Mekanizmaları) Ve parazit popülasyonda genetik mutasyon (lar) veya polimorfizmleri yansıtır. ilaç direnci parazitler ilaç varlığında ilaca duyarlı parazitler üzerinde seçici bir avantaj olacaktır ve tercihen iletilecektir. İlaç direncinin geliştirilmesinde ana faktörler tedavi rejimi (Tablo) tamamlayan subterapötik ilaçların doz ya da kullanımı vardır. Düşük ilaç düzeyi en yatkın parazitleri ortadan kaldırır, ancak ilacı tolere olanlar kurtarmak ve yeniden üretecektir. Zamanla bu ilacın daha yüksek dozlarda tahammül parazitler için sürekli seçime yol açacaktır. Tamamen verilen herhangi bir birey parazitleri ortadan kaldırmak için yeterli bir süre boyunca ilacın yeterli bir konsantrasyonu elde etmek için önemlidir.
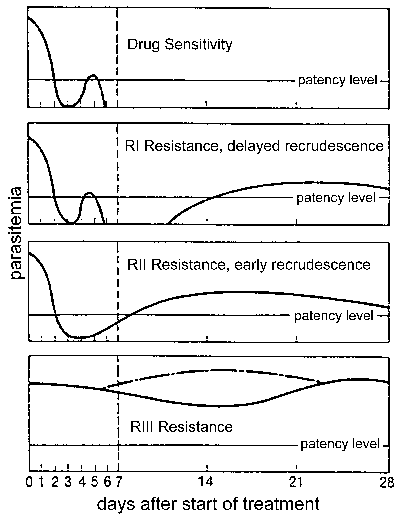
| Faktörler Kalkınma katkıda ve İlaç Direniş yayıldı |
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Klorokin direnci temeli parazitin gıda kofulda klorokin birikimini azalır. Dahası, klorokuin B direnci kısmen, böylece benzer bir olgu meydana gelebilir düşündüren, tümör hücre çizgilerinde çoklu-ilaç direnci (MDR) sorumlu olan p-glikoprotein inhibitörü (bir ABC transportör) ile tersine çevrilebilir Plasmodium. Temin edilen bir MDR-benzeri gen mutasyonlar P. falciparum (PfMDR1) klorokin direnci kapsamına dahil edilmiştir. Ancak, bu mutasyonlar tüm coğrafi bölgelerde klorokin direnci öngörü değildir. Pf MDR1 klorokin direncinin derecesi katkıda bulunduğu görülmektedir, ancak tek başına direnç vermek için yetersizdir. Ancak PfMDR1 meflokine ve Halofantrin direnç rol oynuyor gibi görünmektedir ve artemisinin için hassasiyeti etkiler yok.
Klorokin direncinin genetik lokus için bir başka aday bir genetik çapraz ve haritalama deney vasıtasıyla tespit edildi. Kromozom 7’de 400 kb bölgesi klorokin dirençli ayrılma bulunmuştur ve daha fazla analiz olarak adlandırılan tek bir gen, bu önerilen Pfcrt, klorokin dirençli sorumluydu. Bu gendeki tanımlanan 10 polimorfizmlerinin toplam dışında sadece tek bir mutasyon perfectedly klorokin dirençli fenotip ile ilişkilidir. Kalıntı 76 bir lizin Bu mutasyon sonucu bir treonin (K76T) değiştirilmiştir edilir. Çeşitli alan çalışmaları arasında bir ilişki olduğunu göstermiştir Pf in vivo ve in vitro yöntemler her ikisini de kullanarak crt-K76T ve klorokin direnci. Son zamanlarda en az 4 kurucu mutasyonları olmuştur öne sürülmüştür Pf Asya/Afrika, Papua Yeni Gine, Brezilya/Peru ve Kolombiya (Wootton ve arkadaşları,: Farklı coğrafi bölgeler ile ilişkili crt gen Nature 418: 320, 2002). Muhtemelen klorokin kullanımı daha sonraki bir seçilimi ile sonuçlanmıştır ve dirençli fenotipin yayıldı.
Ilaç direnci üzerinde Yorumlar:
- Boland PB (2001) sıtma ilaç direnci. WHO/CDS/CSR/DRS/2001,4
- Hyde JE (2007) İlaç dirençli sıtma – bir bakış açısı. FEBS Journal 274, 4688-4698.
- Warhust D (2001) Yeni gelişmeler: Klorokin direnç Plasmodium falciparum. İlaç Direnci Güncellemeler 4: 141.
- Wellems TE Plowe CV (2001) klorokin’e dirençli sıtma. J Inf Dis 184: 770.
- Wongsrichanalai Cı, Pickard AL, Wernsdorfer WH ve Meshnick olarak SR (2002) ilaca dirençli sıtma epidemiyolojisi. Lancet Infect Dis 2: 209.